- within Food, Drugs, Healthcare and Life Sciences topic(s)
- in South America
- in South America
- in South America
- with readers working within the Environment & Waste Management industries
- within Food, Drugs, Healthcare, Life Sciences, Privacy and International Law topic(s)
2024年2月4日,我国国家药品监督管理局(NMPA)在官网发布了2023年度药品审评报告。值得一提的是,相较于过去往往等到下半年才发布上一年的年度药品审评报告,2023年度药品审评报告的发布时间提前了不少,报告数据更具时效性。此外,在章节结构上,2023年的药品审评报告也有了较大的调整,报告在整体结构上显得更为系统与清晰
根据2022年与2023年年度药品审评报告中附件所公布的信息,近两年NMPA批准的创新药共达到60余款,见证了我国药物研发创新稳步发展
通过历年年度药品审评报告,我们不仅可以直观地了解我国药品注册申请与审评审批活动情况,也可以观察我国药监部门突出、典型的监管成果,有助于对我国医药产业的发展动态有更加直观的了解。我们也曾通过对我国多年的药品审评报告的解读来回顾国家药品审评审批制度改革的卓越成果。(本所相关文章详见:中国年度药品审评报告解读(2015-2021)——回顾我国药品审评审批制度改革成果(上篇)、中国年度药品审评报告解读(2015-2021)——回顾我国药品审评审批制度改革成果(中篇)、中国年度药品审评报告解读(2015-2021)——回顾我国药品审评审批制度改革成果(下篇))在本文中,我们将继续对2022-2023年度的药品审评报告进行分析解读,挑选报告中的部分重点与亮点内容,以观察近两年中我国在药品监管方面的发展情况与主要成就。
一、 注册申请受理量增加明显
2022年至2023年,我国药品注册申请申报量逐年增加。2022年,药品审评中心(CDE)受理的全部申请总量(包括原料药和制剂)达到12,368件,而这一数字在2023年更是高达18,503件,较2022年增长了35.84%,增幅较过去几年均有所提升。与此同时,2023年药品制剂注册申请总量与技术审评类制剂注册申请总量 1均有相当明显的增长。可见,2023年我国药品研发与注册活动十分活跃。
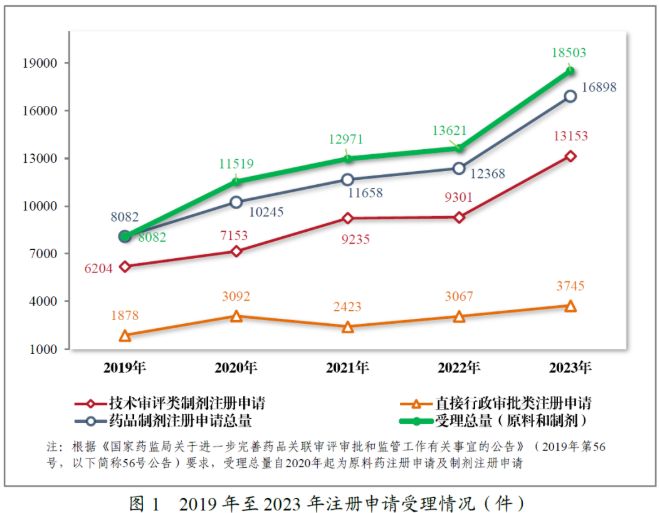
从受理注册申请的药品类型来看,近两年中最值得一提的变化莫过于中药注册申请量的井喷式增长,由2022年的421件增长到2023年的1,163件,增幅高达176.25%。这一变化得益于我国近年来对中医药传承发展的大力政策支持。特别是在2023年2月10日,NMPA发布了《中药注册管理专门规定》,对中药的特色上市评价制度予以探索,旨在全方位地、系统地构建中药注册管理体系。(本所相关文章详见:汉坤 " 观点 | 中药之春?从《中药注册管理专门规定》看中药特色上市评价体系 )我们理解,制度与规则的完善是2023年我国中药注册申请量的大幅提升的主要原因。我们也期待未来我国的中药监管体系愈发完善与成熟,推动更多优秀中药的传承与创新发展。
化学药品一直以来都是我国药品注册申请中占比最大的药品类别,其在2022年至2023年间也保持了增长的趋势,2022年为7,054件(占全部需技术审评的药品注册申请受理量的75.84%),而2023年则达到了9,813件(占全部需技术审评的药品注册申请受理量的74.66%),同比增加39.11%。不过,在2023年度药品审评报告中也提到了注册分类为5.1类的化学药品注册申请量较往年有所减少。
就生物制品而言,其注册申请量在2022年曾经历了小幅减少(较2021年同比减少8.95%),但在2023年又得到了回升。2023年,我国生物制品的新药临床试验申请(IND)数量同比增长33.18%,新药上市许可申请(NDA)数量同比增长48.85%。这一增长反映出了我国生物制品行业持续发展和创新的总体趋势没有改变。随着现代生物技术的迅速发展,生物制品技术和产品不断取得创新突破。近年来,火热发展的ADC药物、RDC药物、mRNA药物、CAR-T/NK/TIL细胞治疗产品等药物为创新医药产品和治疗技术带来新的希望,为医药行业的发展注入火热的动力。
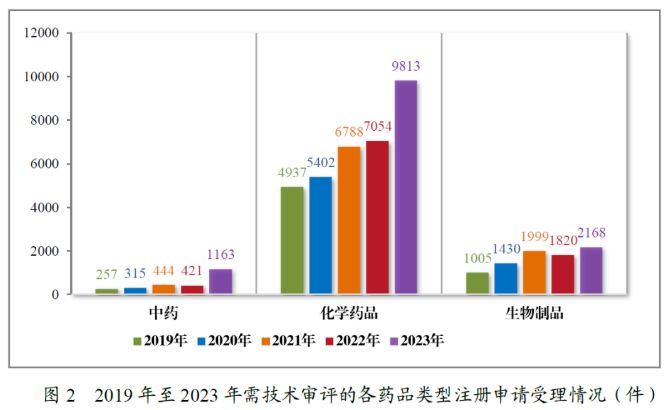
从注册申请的类别来看,CDE受理的新药临床试验申请(IND)与新药上市许可申请(NDA)数量在2022年曾有过小幅下降,但在2023年都有所回升,且达到了2019年以来的最高值。此外,同名同方药、化学仿制药上市许可申请(ANDA)数量在2022年和2023年均有大幅上升(2022年同比增加29.37%,2023年同比增加66.25%)。
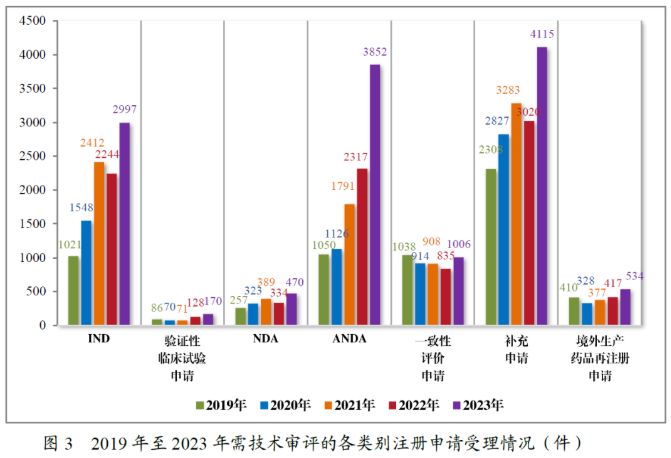
二、 注册申请审结量下降后 有所回升
2022年,我国药品注册申请的审结量 2较往年有所减少,据2022年度药品审评报告所述,这主要是由于新冠疫情的原因导致药品研发创新活动整体受阻,申请人无法按时限返回药品注册申请的补充资料,进而导致药品审评审批的进度也受到了影响。在这样的背景下,CDE还于该年积极发布了《关于暂行延长药品注册申请补充资料时限的公告》,以全力确保审评审批活动的质量与效率。
值得欣喜的是,刚刚过去的2023年见证了我国药品注册申请审结量的整体回升,达到了历年来的最高,共审结15,713件注册申请(包括原料药和制剂),较2022年增长了28.80%。其中,药品制剂注册申请审结量、技术审评类制剂注册申请审结量与直接行政审批类注册申请审结量均有所增长。2023年度药品审评报告中也再次提到了CDE在过去一年里采取了多种措施提高审评效率,加快审评速度,以临床价值为导向,为患者提供更多的用药选择。
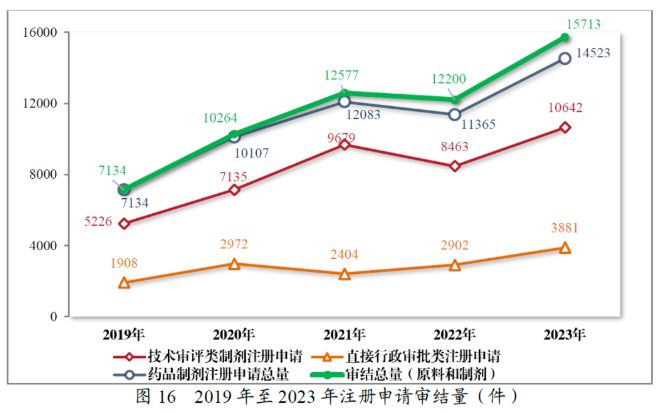
以药品类别来看,2022年,中药、化学药品和生物制品的审结量均有所下降,而在2023年又均有所回升。2023年审结的药品注册申请中,最值得一提的同样是中药注册申请的审结量有了大幅提升,达到878件,同比增长131.05%。过去几年中,化学药品注册申请的审结量一直是所有药品类别中占比最大的。2023年,化学药品注册申请审结量占到全部需技术审评审结量的72.59%。生物制品2023年的注册申请审结量共2,030件,同比增加7.41%,保持着平稳中有所增长的趋势。
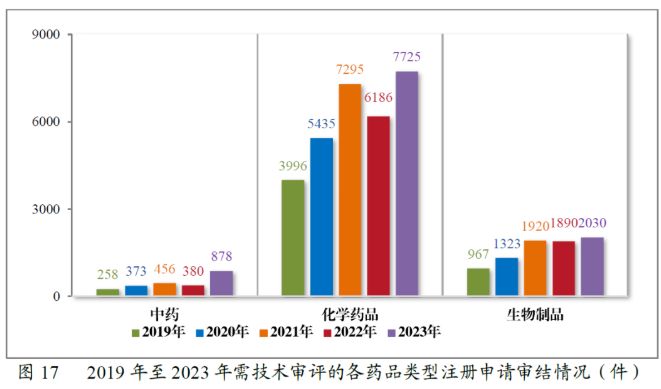
以审评序列来看,2022年CDE审结的IND数量有小幅上升,但NDA、ANDA和一致性评价申请的审结量均有不同幅度的下滑。2023年审结的IND、NDA、ANDA、一致性评价申请等多个申请序列的审结量则均有所上升。
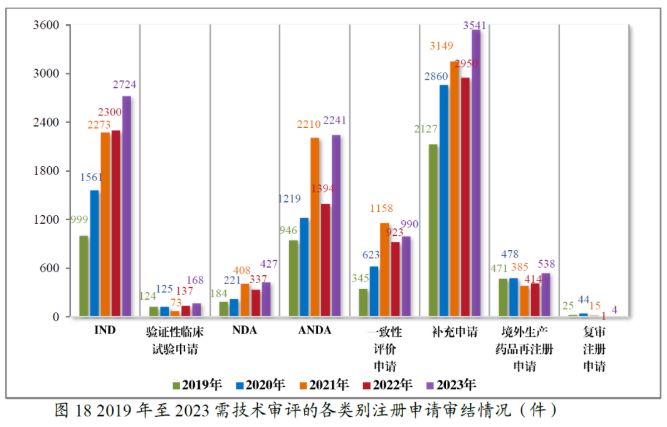
以治疗领域来看,2022年和2023年建议批准的中药NDA分别均涉及了6个适应症领域,常见领域包括了五官、肾脏病和消化药物,而两年中建议批准的化学药品和生物制品NDA均主要集中在抗肿瘤药物领域。
三、 快速通道加快新药、好药上市
2022-2023年,CDE继续通过多样化的药品加快上市注册程序,缩短了药物研发与审评审批时间,促进了更多新药、好药的上市,为患者提供了更多治疗方案。值得一提的是,加快上市注册程序对创新药的上市起到了明显的作用:在2023年批准上市的40个创新药品种中,9个品种通过优先审评审批程序批准上市,13个品种为附条件批准上市,8个品种在临床研究阶段被纳入突破性治疗药物程序.
各个加速通道的法律依据与适用范围整理如下表:
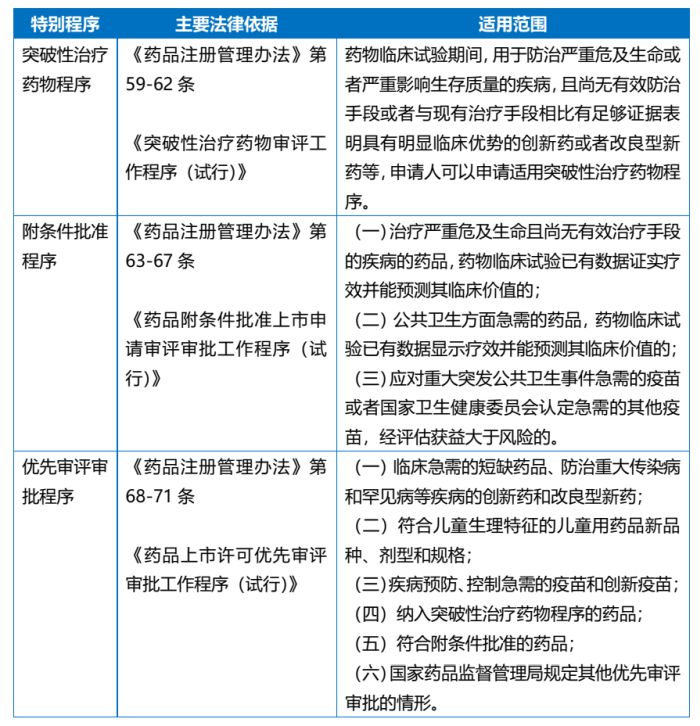
(一) 突破性治疗药物程序
2022年,申请适用突破性治疗药物程序的注册申请共200件,同意纳入的共56件。2023年,CDE总共收到突破性治疗药物程序申请286件,同意纳入的有70件,较2022年增加了43%,申请成功比例约为24%。从适应症领域分布来看,在2023年纳入突破性治疗药物程序的药物中,抗肿瘤药物占比最多,有45件。
(二) 附条件批准程序
2022年,CDE通过建议附条件批准数为32件,到了2023年,这一数字下降为21件。自2021年以来,我国附条件批准上市的药品数量呈逐年下降的趋势。此外,在2022年和2023年中分别有6个和10个附条件批准上市的药品完成了上市后研究,转为了常规批准。据统计,自2020年《药品注册管理办法》明确规定附条件批准程序以来,我国共有95个药品附条件批准上市,涉及107个适应症,其中以抗肿瘤药物为主,占比高达79%。
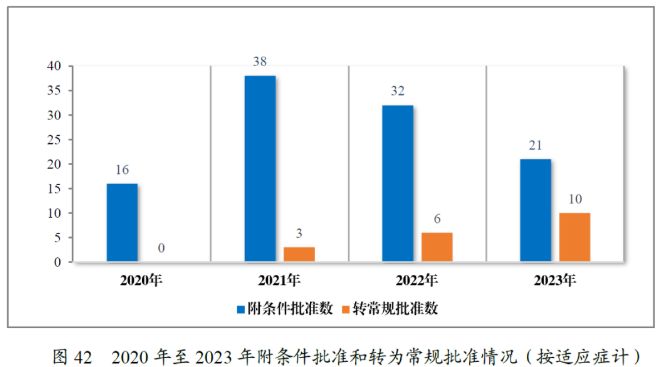
(三)优先审评审批程序
2022年,被纳入优先审评审批程序的注册申请数量为74件,较2021年同比减少了35.65%。而在2023年,被纳入优先审评审批程序的注册申请共108件,较2022年同比增加了56.9%。据统计,自2020年《药品注册管理办法》明确规定优先审评审批程序以来,共有372个药品注册申请纳入优先审评审批程序。与前述的突破性治疗药物程序以及附条件批准程序类似,近年来纳入优先审评审批程序的药物同样以抗肿瘤药物占比最多,高达42%。
四、 支持鼓励创新药的研发 与上市
自深化药械审评审批制度改革以来,我国一直高度重视鼓励医药领域的创新发展,制定了众多政策以支持鼓励更多创新药上市。得益于监管政策的支持,近年来我国创新药的研发活动十分活跃。从2022年至2023年,我国创新药(包括中药、化学药品、生物制品)的申请量和批准量整体上均有不同幅度的提升。具体情况如下表所示:
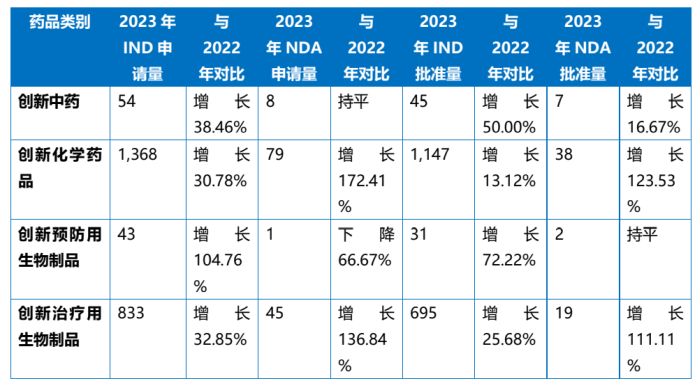
值得一提的是,CDE在2023年度药品审评报告中首次将一年中我国批准的创新药的详细信息情况以附表的形式进行公示,具体内容包括了药品名称、上市许可持有人、药品类型、适应症以及适用的加快上市程序。这对于业界了解创新药的统计标准以及审评情况提供了更加直观清晰的帮助。
五、 多方位满足患者的用药需求
在历年的药品审评报告中,NMPA对于以儿童用药、罕见病用药等为代表的特殊用药一直给予了重点关注。得益于相关审评审批制度的建设发展与诸多其他的制度改革,我国近年来对于这些特殊用药的审评审批工作取得了重要进展
(一)短缺药品
2020年,我国国家卫生健康委员会、国家发展改革委员会等十二部门联合发布了国家短缺药品清单,开始了短缺药品清单管理制度,旨在应对解决药品生产供应端短缺问题,保障药品的稳定供应。
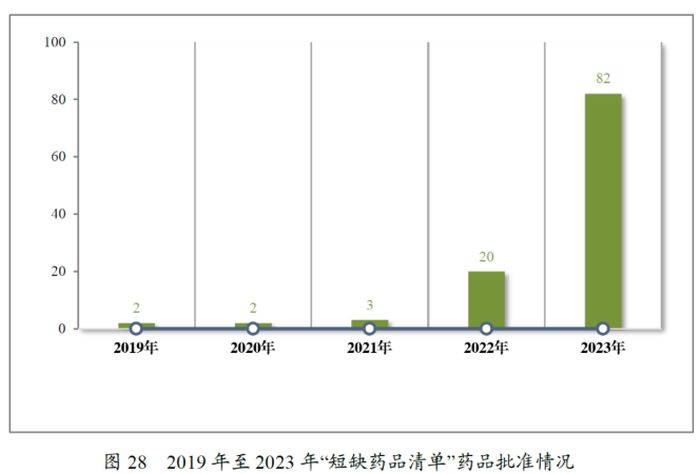
2023年度药品审评报告中首次对短缺药品进行了特别关注。2023年,CDE共建议批准"国家短缺药品清单"药品共82件,同比增长了310%,在保障短缺药品供应上取得了重大进展。近五年来,我国批准上市的短缺药品涉及了生殖系统、循环系统、电解质、神经系统、皮肤及五官科、抗肿瘤等9个治疗领域,多方位保障了患者的用药需求。
(二)儿童用药
2019年至今,我国儿童用药批准数量逐年递增。其中,2022年共有66个儿童用药获批上市。2023年全年批准儿童用药 92 个品种,包含72个上市许可申请和20个品种扩展儿童适应症。儿童用药批准数量不断创历史新高,让更多的儿童患者和千万家庭从中受益。
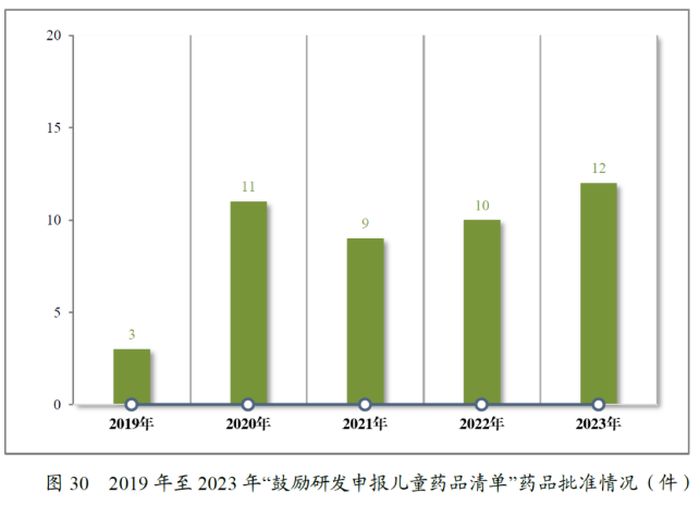
自2016年起至今,我国一共研究制定了四批鼓励研发申报儿童药品清单,以促进儿童适宜品种、剂型、规格的研发创制和申报审评,从而满足儿童临床用药的需求。2022年至2023年,CDE分别建议批准在清单上的儿童用仿制药10和12件,有小幅增长。近五年来,我国累计建议批准清单上的儿童用仿制药45件,涉及了神经系统、抗肿瘤、内分泌系统等8个治疗领域,多方位保障儿科患者的用药需求。
在政策制定方面,2023年3月发布的《药审中心加快创新药上市许可申请审评工作规范(试行)》中也强调了鼓励支持儿童用创新药的研发与审评审批。CDE还制定发布了《生理药代动力学模型在儿科人群药物研发中应用的技术指导原则》等诸多适用于儿童用药的指导原则,以加快儿童用药的研发进程,提高儿童用药的可及性。
此外,2023年度药品审批报告中还提到CDE于2023年4月12日发布了儿童用药技术审评临床外聘专家名单,扩大了儿童用药专业领域专家力量,有助于进一步提升儿童用药的监管审评质量。
(三)罕见病用药
2023年,我国共批准上市罕见病用药45个品种,其中15个品种(33.3%)通过优先审评审批程序得以加快上市,1个产品通过附条件批准上市。涉及的适应症包括尿素循环障碍(UCD)、婴儿严重肌阵挛性癫痫(SMEI,Dravet综合征)、失盐型先天性肾上腺皮质增生症(CAH)及失盐型原发慢性肾上腺皮质功能减退症(Addison病)等多种罕见疾病。同样在2022年,在74件纳入优先审评审批程序的注册申请中,临床急需的短缺药品、防治重大传染病和罕见病等疾病的创新药和改良型新药共17件,占比22.97%。CDE优先审评资源逐年向具有临床优势的新药、罕见病药物等药品注册申请倾斜
政策制定方面,2023年3月发布的《药审中心加快创新药上市许可申请审评工作规范(试行)》中也强调了鼓励支持用于治疗罕见病的创新药的研发与审评审批。一直以来,CDE都在努力推动我国罕见病药物的研发,为边缘化的罕见病患者带来更多治疗方案与生存希望。
(四)细胞治疗产品
近年来,我国生物医药技术变革发展迅猛,不断取得新的突破。以细胞治疗、基因治疗等为代表的新一代疗法日渐成熟。2023年,我国全年批准CAR-T细胞治疗产品3个,包括附条件批准伊基奥仑赛注射液、纳基奥仑赛注射液上市,附条件批准阿基仑赛注射液增加新适应症。
CDE在2023年也发布了不少与细胞治疗产品研发相关的指导原则与规范性文件,如6月发布的《人源性干细胞及其衍生细胞治疗产品临床试验技术指导原则(试行)》以及11月发布的《自体 CAR-T细胞治疗产品药学变更研究的问题与解答》等。相关政策文件的发布旨在更好地指导相关产品的研究与申报。
值得注意的是,在药品注册监管外,近年来我国卫健委同样在积极探索CAR-T/NK等体细胞治疗产业的监管模式。2023年8月18日,中国医药生物技术协会(CMBA)受国家卫生健康委委托发布了《体细胞临床研究工作指引(试行)》,为业界不断探索和发展细胞治疗技术提供了合规指引。(本所相关文章详见:汉坤 " 观点 | CAR-T/NK监管靴子落地 — 解读《体细胞临床研究工作指引要点(试行)》)
六、 真实世界研究政策与应用 进一步发展
随机对照试验通常被认为是评价药物安全性和有效性的金标准,为药物临床研究所普遍采用,且是药品注册上市的主要依据。真实世界研究则是与随机对照试验相对的概念,指的是在真实世界环境下收集相关数据,通过汇总、分析和处理,获得对药物安全性和有效性等的评价。近年来,为了加快创新药上市,我国也在不断探索真实世界研究数据在药品注册上市中的应用政策,有不少相关的指导原则发布实施。
2023年,CDE发布了多个指导原则,持续完善真实世界证据指导原则体系。CDE于2023年2月发布了《药物真实世界研究设计与方案框架指导原则(试行)》,以指导申办者科学合理地设计真实世界研究,明确真实世界研究方案撰写的技术要求,同时也为后续与ICH M14的协调提供技术储备。CDE还同时发布了《真实世界证据支持药物注册申请的沟通交流指导原则(试行)》,以阐述使用真实世界证据在关键时间节点开展沟通交流的核心问题,帮助申请人提高研发效率,促进在真实世界研究领域的深入实践。值得一提的是,2023年度药品审评报告中还提到CDE计划制定真实世界在中药临床疗效评价中的应用技术指导原则。由于人用经验证据是中药上市评价体系的重要特色,与真实世界研究有较大关联,如何在中药的研发与注册上市中更好地应用真实世界证据,值得业界的关注。
七、 监管指导机制日益成熟
在药物研发与注册申请的过程中,申请人往往需要就具体产品的研发与注册情况与CDE进行沟通讨论,以明确产品研发与申请的审评要求等事项。与申请人开展沟通交流会议,是CDE指导、服务申请人的重要举措。2023年度药品审评报告更是以专章形式公布了一年中开展沟通交流的情况。
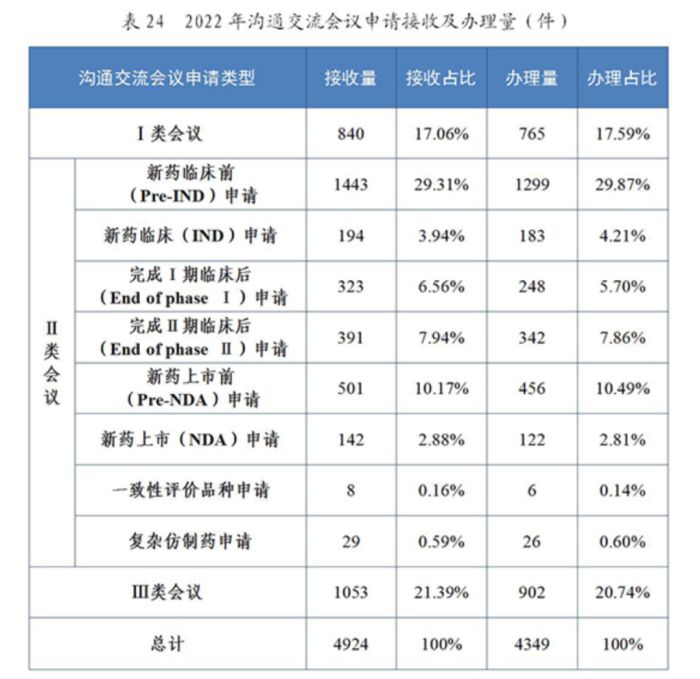
据统计,2022年,CDE共接收沟通交流会议申请4,924件,而在2023年则共接收了5,912件,同比增长了20.06%。2023年,CDE累计为1,607家企业提供了沟通交流服务,办理沟通交流会议申请的数量由2022年的4,349件上升至5,549件,同比增长了27.59%。可见,沟通交流会议越来越广泛地成为了申请人与监管部门之间沟通的桥梁,申请量与办理量均逐年增加,监管部门为申请人提供的服务越来越充分。
从会议类型来看,2022年与2023年均以药物在研发关键阶段而召开的会议(II类会议)为占比最多的类型,分别达61.67%和54.69%,在这其中,又均以在新药临床前(Pre-IND)申请阶段办理沟通会议的为主
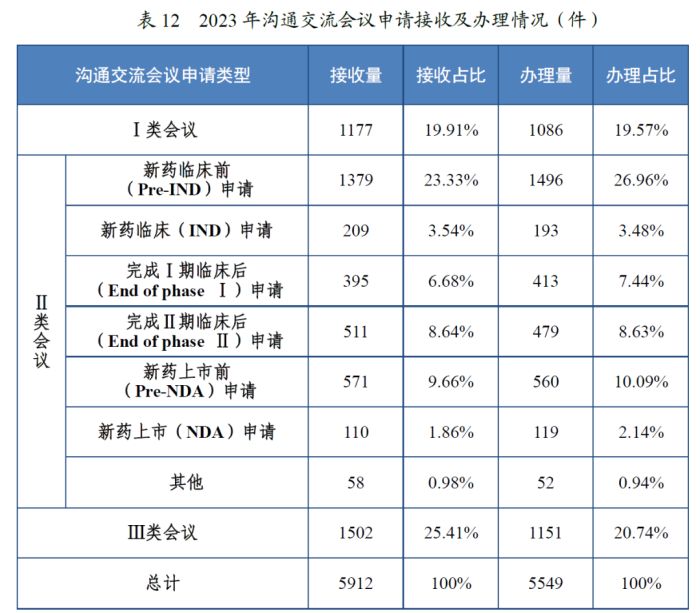
此外,为了更好地指导申请人的产品研发与注册活动以及监管部门的审评审批活动,2022年和2023年CDE分别制定发布了61和60份新指导原则。目前,CDE累计发布的药品技术指导原则数量已高达482个,我国药品审评标准体系建设持续完善。近年来CDE新发布的指导原则覆盖内容广泛,涉及了细胞和基因治疗技术评价体系、真实世界研究政策、特殊群体用药需求等多个方面,聚焦了国际前沿技术领域,以推动我国的指导原则体系与国际先进技术标准的融合接轨。
八、 总结与展望
回顾2023年我国的药品审评审批情况,可以发现多年来我国深化药械审评审批制度改革已经取得了显著的成效。从产品研发与申请人的角度,近年来在我国注册申请的产品数量与质量都有了大幅度的提升。从监管科学的角度,我国药监部门的审评工作越来越规范、协调、高效,也能够越来越能够服务于广大申请人的需求。成熟完善的监管体系将为更多创新、优质药品的研发和上市保驾护航,技术与制度的共同进步将合力推动我国医药产业的蓬勃发展,让更多的患者享受到更多、更优质的产品。
Footnotes
1. 在药品审评报告中,药品制剂注册申请在统计时被分为技术审评类制剂注册申请以及直接行政审批类注册申请两类,后者主要包括无需技术审评的补充申请以及临时进口注册申请。
2. 根据2023年度药品审评报告待中的解释,报告中所称“审结”包括:完成技术审评报送国家局审批、完成技术审评后以国家局名义审批、不需要技术审评以国家局名义直接审批。“审结”不包含已完成技术审评后,因需申请人补充资料、发出补充资料通知书的注册申请。
Originally Published 28 April 2024
The content of this article is intended to provide a general guide to the subject matter. Specialist advice should be sought about your specific circumstances.






