- within Food, Drugs, Healthcare and Life Sciences topic(s)
- within Food, Drugs, Healthcare, Life Sciences, International Law, Government and Public Sector topic(s)
近日,国家卫生健康委员会(下称" 国家卫健委")、国家中医药局和国家疾控局三部委联合发布了《医疗卫生机构开展研究者发起的临床研究管理办法》(下称" 《IIT管理办法》"),自2024年10月1日起正式施行。在此之前,国家卫健委曾发布过《医疗卫生机构开展研究者发起的临床研究管理办法(试行)》(下称" 《试行稿》")对IIT研究 1进行监管,《试行稿》于2021年10月1日在北京、上海、广东、海南开展试行。试行期间,医疗卫生机构在开展IIT研究的实践中积累了较多经验,《试行稿》完成其使命,《IIT管理办法》正式落地。
《IIT管理办法》与《试行稿》在IIT研究的定义、分类、协议签订、财务管理以及登记备案等许多重要方面保持一致,整体变化不大。但其出台与落地依然对我国IIT研究的开展和监管有着重要意义。多年来,IIT研究对于还未达到注册临床试验条件的新技术有着不可或缺的作用,笔者即曾协助众多CGT(细胞与基因治疗)领域的Biotech公司利用优质的IIT数据推动公司的进一步融资和BD(商业合作)。本文将选取《IIT管理办法》与《试行稿》相比的几点主要变化进行解读,以期为行业各方提供关于我国IIT研究监管动态的参考。

《IIT管理办法》第一条调整了该办法的上位法依据,较《试行稿》新增了《涉及人的生命科学和医学研究伦理审查办法》 2(下称"《2023年伦理审查办法》")。
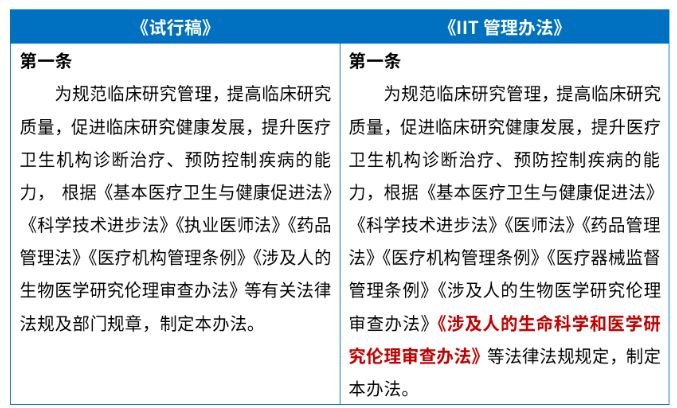
《2023年伦理审查办法》明确以人为受试者或者使用人的生物样本、信息数据开展的生命科学和医学研究活动受其规制。IIT研究作为以人(个体或群体)为研究对象的研究活动 3,其监管规则也需要与《2023年伦理审查办法》协调一致。此处添加完善了该办法的上位法依据。(关于《2023年伦理审查办法》中规定的要点,请详见我们的解读文章:《汉坤 " 观点 | 伦理审查新规重点快评。)

《IIT管理办法》第二条删除了《试行稿》中对 "医疗卫生机构"范围的定义。
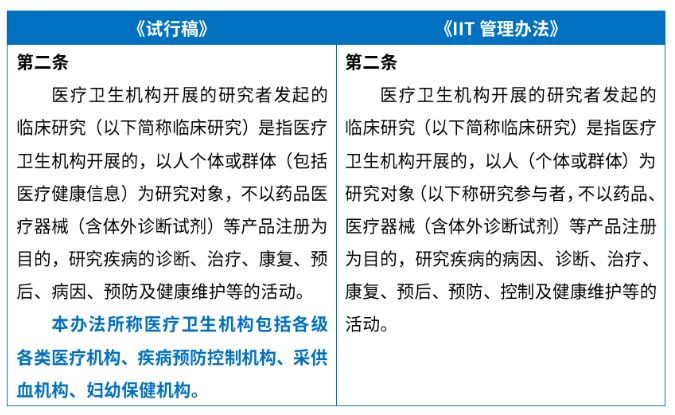
我们理解,在《IIT管理办法》中删除"医疗卫生机构"的定义,主要是因为在上位法《基本医疗卫生与健康促进法》中已经对该定义的范围予以明确 4,这一调整使得立法语言在整体上保持了一致性;此外,在外商投资医疗机构的形式逐步多元、政策不断开放的同时,简洁的处理也为本办法的适用范围留有空间。

除了删除医疗卫生机构的定义之外,《IIT管理办法》第二条研究对象的描述中删除了"包括医疗健康信息"的括号说明。

我们理解,这一处删除更多是出于语言逻辑的文字修改,但并不意味着人个体或群体的医疗健康信息不再受到《IIT管理办法》的约束(除非相关部门进一步出台说明以明确豁免)。《IIT管理办法》中以人(个体或群体)作为研究对象的表述,不能排除对以人(个体或群体)的医疗健康信息为研究对象开展的研究。

相较于《试行稿》,《IIT管理办法》第四条删除了对于医疗卫生机构及其研究者应当"取得法律法规要求的临床资质"的要求。

区别于适用于IST的《药物临床试验质量管理规范》(GCP)中对研究者和临床试验机构应当具备的资质要求做了明确规定,目前我国法律法规中总体上缺乏对开展IIT研究的相关资质的明确要求。我们理解,《IIT管理办法》删除这一表述,可在一定程度上降低实践中IIT研究的主体开展研究的疑虑,也给予开展IIT研究的主体以更多灵活空间。
当然,实践中,针对特定类型的IIT研究可能会规定具体的资质要求,比如在《干细胞临床研究管理办法(试行)》和《体细胞临床研究工作指引(试行)》中,就针对开展干细胞和体细胞临床研究的医疗机构须具备的条件做了明确要求。(关于体细胞临床研究的相关监管要点,请详见我们的解读文章:《汉坤 " 观点 | CAR-T/NK监管路在何方 — 体细胞临床研究工作指引(征求意见稿)要点解读》《汉坤 " 观点 | CAR-T/NK监管靴子落地 — 解读<体细胞临床研究工作指引要点(试行)>》。)此外,各地方的监管部门也可能对辖区内开展IIT研究的资质有所要求。实践中,医疗卫生机构和研究者在开展IIT研究时,仍需密切关注并遵循所适用的法规和监管要求。

根据研究者是否基于研究目的主动施加某种干预措施,IIT研究可以分为 干预性研究和观察性研究两类。《试行稿》明确规定所有临床研究均应通过科学性审查和伦理审查,《IIT管理办法》删除了此规定,仅明确干预性临床研究需开展科学性审查。这意味着,《IIT管理办法》对观察性研究的管理更加宽松,实践中观察性研究的立项启动条件或可得到简化。
(一)科学性审查
临床研究的科学性审查一般是研究机构立项管理的第一步。科学性审查主要针对IIT研究的设计是否科学、合理而展开审查 5,有助于保证IIT研究的方案设计质量。《IIT管理办法》将《试行稿》中"所有临床研究均应通过科学性审查"的要求缩减为仅"对干预性临床研究组织开展科学性审查"。

我们理解,观察性研究不对研究参与者施加研究性干预措施,对研究参与者可能造成的权益损害相对较低。因此,对观察性研究不再强制要求科学性审查,有助于提高观察性研究的开展效率。
(二)伦理审查
不同于对科学性审查的免除,观察性研究在原则上仍应通过伦理审查,但《IIT管理办法》提及,在"另有规定"的情况下可以豁免伦理审查。

我们理解,这一修改与《2023年伦理审查办法》第三十二条相呼应。《2023年伦理审查办法》中创设性地规定了免除伦理审查的制度安排 6。(关于免除伦理审查制度的要点,请详见我们的解读文章:《汉坤 " 观点 | 伦理审查新规重点快评》。)实践中,观察性的IIT研究有可能满足以上情形从而被免于伦理审查。

我国在2014年发布实施的《医疗卫生机构开展临床研究项目管理办法》中,曾明确要求开展临床研究 7的医疗卫生机构应当成立临床研究管理委员会和伦理委员会,临床研究管理委员会负责医疗机构临床研究的决策、审核、管理和监督。《试行稿》第十五、十六条中也重申了前述法规中的相关要求,而此次《IIT管理办法》中将临床研究管理委员会的"决策、审核"职责修改为了"协调、服务"职责。

我们理解,虽然法规早在2014年就有所要求,但据有关统计,实践中部分医疗机构并没有设置临床研究管理委员会,或者虽然名义上设置了委员会,但没有设立单独的管理部门或配备专门工作人员。与原先的定位相比,"协调与服务"或许更贴合临床研究管理委员会的实际情况。《IIT管理办法》基于试点期间的经验,在语言上作此调整,在一定程度上弥合了办法与实践的差异,增强了办法的适用性。

《IIT管理办法》第三十五条强调,医疗卫生机构在承担对IIT研究全程监管、定期核查的义务之外,还应当对IIT研究提供必要的人力、财力和其他资源方面的支持。

我们注意到,卫健委等监管部门近年来非常支持高质量IIT研究的开展,IIT研究对于推动我国医学科研和临床水平的提升具有重要意义。此变动意味着医疗卫生机构不仅要对IIT研究进行全程监管,还需要在资源配置上给予充分的支持,以确保IIT研究的顺利开展和高质量完成。

随着《IIT管理办法》的出台和落地,我国又将迎来临床研究领域的一个重要里程碑。我们相信,在各方的共同努力下,我国的IIT研究将迎来更加蓬勃的发展,从而推动医学科学的进步,最终造福广大患者和社会。未来,我们期待更多高质量的IIT研究成果不断涌现,为健康中国的建设贡献更多智慧和力量。
Footnotes
1. IIT(Investigator Initiated Trial)研究,通常是指由医疗机构的研究者发起的、不以药品医疗器械等产品注册为目的的临床研究,与药企发起的注册性临床试验(Industry Sponsored Trial, IST)相对应。
2.《涉及人的生命科学和医学研究伦理审查办法》于2023年2月国家卫健委联合教育部、科技部和国家中医药局共同发布,为继2016年《涉及人的生物医学研究伦理审查办法》之后,在国家卫健委的牵头下推出的新一版伦理审查办法。
3.《IIT管理办法》第二条 医疗卫生机构开展的研究者发起的临床研究(以下简称临床研究)是指医疗卫生机构开展的,以人(个体或群体)为研究对象(以下称研究参与者),不以药品、医疗器械(含体外诊断试剂)等产品注册为目的,研究疾病的病因、诊断、治疗、康复、预后、预防、控制及健康维护等的活动。
4. 具体包括基层医疗卫生机构(乡镇卫生院、社区卫生服务中心(站)、村卫生室、医务室、门诊部和诊所等)、医院和专业公共卫生机构(疾病预防控制中心、专科疾病防治机构、健康教育机构、急救中心(站)和血站等)等机构。
5.《IIT管理办法》第二十二条 ...科学性审查的内容应当包括研究的合理性、必要性、可行性,以及研究目的、研究假设、研究方法、干预措施、研究终点、研究安全性、样本量等...
6. 根据《2023年伦理审查办法》第三十二条,免除伦理审查的情形较为有限,主要包括以下四种情形:(1)利用合法获得的公开数据,或者通过观察且不干扰公共行为产生的数据进行研究的;(2)使用匿名化的信息数据开展研究的;(3)使用已有的人的生物样本开展研究,所使用的生物样本来源符合相关法规和伦理原则,研究相关内容和目的在规范的知情同意范围内,且不涉及使用人的生殖细胞、胚胎和生殖性克隆、嵌合、可遗传的基因操作等活动的;(4)使用生物样本库来源的人源细胞株或者细胞系等开展研究,研究相关内容和目的在提供方授权范围内,且不涉及人胚胎和生殖性克隆、嵌合、可遗传的基因操作等活动的。
7. 根据《医疗卫生机构开展临床研究项目管理办法》第二条,临床研究是指在医疗卫生机构内开展的所有涉及人的药品(含试验药物,下同)和医疗器械(含体外诊断试剂,下同)医学研究及新技术的临床应用观察等,理解既包括IST,也包括IIT。
Originally Published 28 September 2024
The content of this article is intended to provide a general guide to the subject matter. Specialist advice should be sought about your specific circumstances.
[View Source]






