- within Food, Drugs, Healthcare and Life Sciences topic(s)
- within Food, Drugs, Healthcare and Life Sciences topic(s)
- within Food, Drugs, Healthcare, Life Sciences, Insurance and Technology topic(s)
一、立法背景及意义
2019年12月1日,《药品管理法》和《疫苗管理法》正式生效,相关规定将我国药物临床试验机构的管理由资质认定制调整为备案制。自此,我国药物临床试验机构迎来了数量上的快速增长,截至目前全国已有超过1400家药物临床试验机构完成备案 1。在变革和发展的同时,临床试验机构管理方面也显露出不少亟待解决的问题。尽管有《医疗机构管理条例》、《药物临床试验机构管理规定》(" 《管理规定》")和《药物临床试验质量管理规范》(GCP)等可适用的监管规范,但对于临床试验机构的监督检查缺乏专门的规范性文件指引。
因此,为更好地与《管理规定》和GCP等监管规范衔接,构建更加完善和更具系统性的药物临床试验机构监管和执法的规范体系,国家药监局于今年7月3日发布了《药物临床试验机构监督检查办法(试行)(征求意见稿)》(" 《征求意见稿》")并公开征求意见,并于11月3日正式发布了《药物临床试验机构监督检查办法(试行)》(" 《办法》")和配套技术文件《药物临床试验机构监督检查要点及判定原则》(" 《检查要点及判定原则》"),《办法》将于2024年3月1日起正式生效。
尽管仍有优化空间,我国临床试验的质量管理在药监部门的重视下于过往数年取得了长足进步。最为行业熟知的事件是在八年前,《关于开展药物临床试验数据自查核查的公告》一文开启了引起行业震动的"722风暴"。药监部门以严格而大规模的自查核查工作和执法力度处置了当时临床试验领域的行业实践和监管过程中的大量顽疾和隐疾,很大程度上净化了药品上市前研发和临床试验阶段的环境。在"722风暴"后,药监部门仍然对临床试验质量核查和监管工作持续关注,经过其多年的探索和发展逐步形成了较为完善的针对临床试验数据真实性和合规性的长效监管机制,并积累了监管经验。
本《办法》为我国药物临床试验机构的监管翻开了新的篇章,是药监部门对于临床试验质量的长效监管机制的延续和补全,也是其从药物临床试验机构侧出发的监管新思路。通过加强事中、事后监管,在释放药物临床试验活力的同时,确保临床试验质量。本文将对《办法》中的监管要点作分析和解读,提出我们对于临床试验各方如何合规应对监管要求的看法和建议,供业界同仁参考和讨论。
二、新规要点解读
(一)监管分工
就进行监管检查的主体而言而言,根据《办法》规定,我国药监部门将负责对药物临床试验机构的备案以及注册性临床试验活动进行监督检查,并将有关情况通报同级卫健部门。《办法》出台前,上位法如由国家药监局和卫健委联合发布的《管理规定》并未明确药监部门和卫健部门在药物临床试验机构监管方面的具体职责,例如第十八条和第十九条仅要求药监部门和卫健部门建立检查员队伍并负责对临床试验机构的日常检查,未作进一步细化。我们理解药物临床试验机构作为医疗机构始终受到我国卫健部门的监管,但同时本次《办法》规定药物临床试验机构的备案以及其注册性临床试验活动将由药监部门负责监管,由此相对明确地划分了药监部门和卫健部门的监管分工
就国家药监局(" 国家局")和省、直辖市级药监局(" 省级局")的分工而言。《办法》第三条和第四条规定,国家局和省级局都将建立临床试验机构检查工作机制和队伍,例如分别建立国家检查员库和省级检查员队伍,负责组织临床试验机构的检查工作。可以预见的是,未来我国药物临床试验机构的监督检查工作和执法力度将进一步增强。
(二)责任主体
对药物临床试验机构和研究者而言。《管理规定》指出,药物临床试验机构是药物临床试验中受试者权益保护的责任主体,应依法开展药物临床试验,就其试验质量承担相应法律责任 2。在《管理规定》和GCP等规范的基础上,《办法》和《检查要点及判定原则》进一步细化了对药物临床试验机构和研究者的法定义务以及相应的监督要求规定。我们理解,临床试验机构和研究者一方面在监管要求下负有法定合规义务,另一方面也对申办者负有合同义务,需要适当履行临床试验协议(CTA)和试验方案等文件约定的义务。
对申办者而言。尽管《办法》主要针对药物临床试验机构和研究者,但对于临床试验申办者的意义不容小觑。对于以药品注册为目的的药物临床试验活动,申办者对临床试验项目负有管理责任,是临床试验数据质量和可靠性的最终责任人,也是临床试验项目成败的重要利益相关方。若对药物临床试验机构的检查发现问题,可能导致该机构不得新开展药物临床试验、不得新入组受试者,可能导致申办者的项目无法正常进行或者耽搁进展。药物临床试验机构管理出现问题,也可能直接导致临床试验项目质量不佳、数据质量和可靠性出现问题,进而影响药品申报进展。因此,企业需要充分重视《办法》要求,加强临床试验项目质量管理、视需要积极参与和配合药监部门检查工作,这也符合GCP第三十五条对申办者的责任要求 3。
(三)检查类型
就机构检查而言,根据《办法》规定,检查工作将分为日常监督检查、有因检查和其他检查,不同类型检查可以结合进行,具体如下:
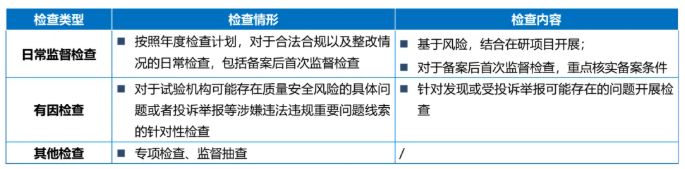
此外,《办法》亦提到注册核查问题。《办法》规定,药品注册核查发现试验机构质量管理体系存在相关问题的,参照本办法进行评定和处理。如前文提到,我国药监部门历来重视临床试验质量管理和对临床试验数据的核查。突如其来的"722"监管风暴曾作为一剂沉疴猛药,治理了申报项目中药物临床试验数据存在的问题。近年来,《药品注册核查工作程序(试行)》《药品注册核查要点与判定原则(药物临床试验)(试行)》等工作文件逐步建立了我国药物临床试验数据成熟完善的长效监管机制。本次《办法》的出台,为药品注册核查中试验机构质量管理体系的检查提供了进一步的制度支撑,在试验机构监管一侧补全了我国临床试验监管机制。
可以看到,就监管的模式而言,《办法》旨在从临床试验机构和研究者出发,确保开展临床试验的主体符合法律法规规定的资质和要求,一方面避免限制备案制下形成的临床试验机构有效扩增的良好局面,另一方面通过对开展主体的事中事后检查,达到对临床试验本身及其数据的质量和合规的监管。就检查的手段而言,《办法》旨在通过对机构和人员的日常或针对性检查,以开展试验的主体和源头上提升临床试验质量。相信《办法》的出台将通过完善临床试验机构日常监管工作,形成从临床试验立项开展到临床试验数据申报更广的监管覆盖和质量监控。
(四)检查依据与检查重点
根据《检查要点和判定原则》列示,现场检查项目内容的依据主要为GCP和《管理规定》中的要求。因此,被检查机构应严格对照GCP、《管理规定》以及《检查要点和判定原则》中的要求和项目,做好药物临床试验合规工作,以应对执法检查。
《办法》中还对检查重点进行了明确。第九条规定,对试验机构、试验专业或者研究者存在以下情形的,应当纳入检查重点或者提高检查频次:
(一) 既往存在严重不合规问题的;
(二) 研究者同期承担临床试验项目较多、研究者管理能力或者研究人员数量相对不足等可能影响试验质量的;
(三) 投诉举报或者其他线索提示存在质量安全风险的。
值得注意的是,本条的第(二)项情形指向了实践中的研究者对临床试验项目管理不力的问题。事实上,我国临床试验资源分布存在较为不均衡的现象,部分热点省市的三级甲等医院往往积压了非常多的临床试验项目,这一点在国家药监局历年发布的《中国新药注册临床试验进展年度报告》中亦有所体现;而从主要研究者的角度,业界地位高、有一定声望的主要研究者,也成为各大药企就其拟开展的临床试验需要争抢的核心资源,部分主要研究者往往同时参与数个临床试验项目,并履行各个项目的相关责任。临床试验机构和部分主要研究者在同期承担过多临床试验项目可能对临床试验的质量产生负面影响,也已经成为实践中各方矛盾和项目风险的产生源头之一。因此《办法》明确将"研究者同期承担临床试验项目较多"列为检查重点或者须提高检查频次的情形。《检查要点及判定原则》中,亦列明要将"确保研究者及其团队同期承担临床试验项目数或者入组受试者例数受到合理控制,有足够的时间和资源实施临床试验"作为检查要点。此前,《办法》中的相关规定就曾引起行业的关注和热烈讨论,也有观点认为,《办法》的出台或许将成为又一次"722风暴"的开端。我们认为,实践中研究者对临床试验项目管理不力的问题已引起监管部门的重视,并可能成为药监部门对临床试验机构日常监管中的关注重点,虽然不必过度警觉,但企业在与临床试验机构和主要研究者合作时,应对这一点进行慎重考虑。
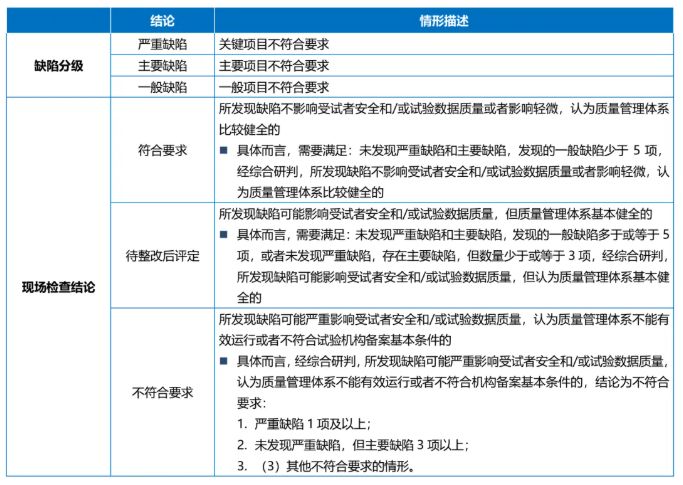
(五)检查结论
《办法》对现场检查发现的缺陷进行了风险分级,分为严重缺陷、主要缺陷和一般缺陷。检查组应根据检查发现的缺陷数量和风险等级,综合研判作出 现场检查结论。现场检查结论分为符合要求、待整改后评定、不符合要求。《检查要点和判定原则》中则进一步细化了认定标准。具体而言,根据《办法》以及《检查要点和判定原则》的规定,对各情形所对应现场检查结论的梳理总结如下表:
检查组在完成现场检查后,应在5个工作日内将现场检查报告、现场检查记录、缺陷项目清单及其他现场检查相关资料报送检查派出机构。被检查机构应当对检查组发现的缺陷进行整改,在现场检查结束后20个工作日内将整改报告提交给药品检查机构。
药品检查机构自收到检查组现场检查报告等相关资料后20个工作日内进行审核,作出 综合评定结论并提出处理意见,形成综合评定报告。对待整改后评定的,药品检查机构应当自收到整改报告后20个工作日内作出综合评定结论并提出处理意见。药品检查机构作出的 综合评定结论分为符合要求、不符合要求。药品检查机构应当及时将综合评定报告报送同级药品监督管理部门。
综合评定的方法并非吹毛求疵,但在关键要求和环节坚持要求与原则。我们理解这也代表监管机构对临床试验机构的合规实践水平具有客观、现实的认识与期待。具体而言,根据《检查要点和判定原则》,综合评定结论的判定原则梳理总结如下表:

总体而言,与《征求意见稿》相比,《办法》在这一点上的规定更为严格,也更有利于检查的实践操作。一方面,《征求意见稿》并未对检查组的现场检查结论的类型进行明确,而仅明确了检查机构的综合评定结论的类型,相较而言《办法》对两者都进行了明确,在程序要求上更为合理清晰,更加有助于检查工作有序地开展;另一方面,《办法》将"所发现缺陷可能影响受试者安全和/或试验数据质量,但认为质量管理体系基本健全的"的情形,从《征求意见稿》的" 基本符合要求"调整为" 待整改后评定",综合评定结论应在被检查机构出具整改报告后作出,由此综合评定结论仅包括"符合要求"和"不符合要求"两项,避免了综合评定结论的不明确。
(六)检查程序和工作衔接机制
《办法》第三章对检查机构与检查组开展检查的程序进行了明确,建议被检查机构以及申办者也应对检查程序要求进行熟悉,从而能够更好地、适时地维护自己的合法权益。比如,除了有因检查之外,原则上药品检查机构应在检查前5至7个工作日通知被检查机构,检查组开始现场检查时,应召开首次会议向被检查机构出示并宣读检查通知,确认检查范围,告知检查纪律、廉政纪律、注意事项以及被检查机构享有的权利和应当履行的义务。被检查机构可以充分利用这些程序节点积极做好应对准备,就检查的流程、内容和安排等进行自查和熟悉,以更好地配合检查的顺利完成和维护自身在检查期间的权益。我们理解,药企作为申办者,其研究管理团队也可以视需要积极参与并配合协助检查工作的开展,从而可以更加直接地维护和保障企业在试验药品中的正当权益。再比如,在现场检查结束时,对现场检查情况有异议的,被检查机构可以通过合理行使陈述申辩的权利维护自身权益,检查组应当如实记录,并结合陈述申辩的内容确定发现的缺陷,形成缺陷项目清单。
另外,《办法》第四章对检查有关工作衔接进行了规定,有助于实践中各监管部门之间互相配合,更好地开展监管工作。其中值得关注的是,《办法》第三十一条规定了对申办者和生物样本检测单位的延伸检查,检查组在对试验机构检查中如果发现申办者、生物样本检测单位等涉嫌存在严重质量问题的,应报告检查派出机构,由检查派出机构及时组织检查。鉴此,作为延伸检查的潜在检查对象,申办者也应重视提前了解与积极配合检查工作的动向,保证药物临床试验顺利进展。另外,对于存在系统性、区域性风险等涉及面广、性质严重的违法行为的,《办法》规定省局应向国家局报告并提出处理意见,视情况可能对相关违法行为开展全国或者跨省查办。
(七)检查处置措施
《办法》对综合评定结论为符合要求和不符合要求的临床试验机构,分别规定了对应的处置措施,如下表。

其中,对于被要求暂停开展临床试验或被取消备案的情形,《办法》也详细规定了进一步的处理措施,具体如下表整理。临床试验机构往往同时开展不同申办者的多个临床试验,因此具体临床试验项目可能因为共享临床试验机构的合规情况而互相牵连影响。值得注意的是,由于临床试验的开展涉及到众多受试者的生命、健康权益,因此《办法》强调了即使被暂停临床试验甚至被取消备案的机构或者专业,也应当注意采取措施保障已入组受试者的权益和安全。

(八)对检查人员的约束机制
《办法》对药品检查机构和人员提出了约束机制。值得一提的是,本《办法》明确了药品检查机构应当建立 检查质量管理体系,这一要求对于实践中检查机构统一工作程序与检查标准将起到重要作用。
为了保障被检查机构的合法权益,《办法》还明确了一系列确保监督检查廉洁、公正的措施,包括:检查人员应严格遵守法律法规、廉政纪律和工作要求,不得向被检查机构提出与检查无关的要求;在检查前应当接受廉政教育,签署承诺书和无利益冲突声明;与被检查机构存在利益关系或者有其他可能影响检查结果公正性的情况时,应当主动声明并回避。此外,由于临床试验数据等材料往往涉及到企业重要的技术及商业秘密,实践中部分企业担心监管检查会导致泄密,本次《办法》尤其强调了检查人员应严格遵守保密要求。
三、影响与合规应对
(一)对于临床试验机构和研究者
对于临床试验机构和研究者而言,其作为本次《办法》中的被检查对象,将成为《办法》下的监管和执法活动的关注重点。首先,临床试验机构和研究者应当确保自身严格遵守GCP等相关法律法规下的要求,依法合规开展临床试验。如果在检查中被发现不符合要求的,不仅会被要求暂停新开展临床试验,还可能将面临五年内不得开展临床试验项目,甚至被取消试验机构或者试验专业备案,严重影响机构的后续试验开展和运营。其次,除了法律法规规定的行政处罚之外,违反GCP要求也通常会导致对其在临床试验协议下的合同义务的违反,引起合同层面的民事赔偿责任。最后,临床试验开展的情况也会影响到申办者的商业权益,因此临床试验协议中往往会约定,临床试验机构应就政府检查对申办者负有包括及时通知等在内的义务,对此,临床试验机构与研究者还应注意及时通知申办者监督检查的发生、结果、处理等一系列信息,保障申办者的参与及知情权益。
(二)对于申办者
对于申办者而言,需要尤其关注在临床试验协议中如何最大程度保护自身的权益,比如重点关注临床试验机构及研究者的责任义务以及相应的赔偿条款。比如,对于因其他申办者开展的临床试验不合规,而导致临床试验机构在监督检查中受到处罚、进而间接导致自身项目的开展也受到影响等各种情况,申办者在临床试验协议的起草与谈判中,需要明确自身的权益并予以足够的重视。其次,申办者在选择临床试验机构和研究者的时候,也应更加关注机构的资质情况和质量管理水平,尤其可以关注主要研究者在同时期负责项目的数量等情况,避免因此导致项目质量出现问题或在监管部门的检查中出现不利于试验开展的评价结果。最后,申办者应树立正确的思想认知,不因政府加强监督检查而产生抗拒、抵触之心,主动参与并积极配合执法检查,在临床研究项目启动的事前、事中都关注相关执法检查的信息,并在合法合规的前提下行使自身的权益。在加强监管的背景下,申办者更应当顺势推动内部合规体系和规范建设,确保在监管和执法日益加强的未来获得合规层面的先发优势,以有利于顺利推进药品的研发和注册进程。
(三)对于CRO和SMO
最后,对于临床研究组织(CRO)和临床试验机构管理组织(SMO)等第三方机构而言,也应当重视开展服务过程中GCP等法规的合规性,保证服务过程和成果的质量,并实施相应的质量保证和质量控制措施,以协助机构更好地完成临床试验质量管理。尤其需要注意的是,CRO、SMO以及其派出的人员应严格在其职责范围内工作,例如临床协调员(CRC)不应从事非医学性判断的事物性工作以外的工作。申办者在对CRO和SMO等机构进行管理时,建议在服务协议中明确上述事项,并明确其有权对CRO和SMO进行的活动进行及时有效的管理、沟通和核查,以确保其遵守共同商定的流程要求。
Footnotes
1. 数据来源于药物临床试验机构备案管理信息平台。
2. 《药物临床试验机构管理规定》第十一条和第十三条。
3. 根据《药物临床试验质量管理规范》第三十条规定,申办者应当履行管理职责,根据临床试验需要可建立临床试验的研究和管理团队,在药品监督管理部门检查时,研究和管理团队应当派员参加。
4. 《药品管理法》第一百二十六条:除本法另有规定的情形外,药品上市许可持有人、药品生产企业、药品经营企业、药物非临床安全性评价研究机构、药物临床试验机构等未遵守药品生产质量管理规范、药品经营质量管理规范、药物非临床研究质量管理规范、药物临床试验质量管理规范等的, 责令限期改正,给予警告;逾期不改正的, 处十万元以上五十万元以下的罚款;情节严重的, 处五十万元以上二百万元以下的罚款,责令停产停业整顿直至吊销药品批准证明文件、药品生产许可证、药品经营许可证等,药物非临床安全性评价研究机构、药物临床试验机构等 五年内不得开展药物非临床安全性评价研究、药物临床试验,对法定代表人、主要负责人、直接负责的主管人员和其他责任人员,没收违法行为发生期间自本单位所获收入,并处所获收入百分之十以上百分之五十以下的罚款,十年直至终身禁止从事药品生产经营等活动。
Originally Published 16 December 2023
The content of this article is intended to provide a general guide to the subject matter. Specialist advice should be sought about your specific circumstances.
[View Source]




