- within Food, Drugs, Healthcare and Life Sciences topic(s)
- within Food, Drugs, Healthcare and Life Sciences topic(s)
- within Food, Drugs, Healthcare, Life Sciences, Insurance and Technology topic(s)
在前一篇文章 《60余款创新药获批:2022-2023年度中国药品审评报告亮点解读》 中,我们对2022-2023年度药品审评报告中所体现的我国近两年药品注册与监管亮点进行了解读。每年,我国国家药品监督管理局(NMPA)除了针对药品发布年度药品审评报告之外,也会针对医疗器械发布年度医疗器械注册工作报告。
2024年2月5日,NMPA在官网上发布了2023年度医疗器械注册工作报告。该报告对过去一年中我国医疗器械注册申请与审评审批活动的情况进行了统计、总结,同时也能够反映出我国药监部门在这一年中突出、典型的监管工作与成果。本文将对2023年度医疗器械注册工作报告进行分析解读,以观察过去一年中我国在医疗器械监管方面的发展情况与主要成就。
一、注册申请受理量平稳上升
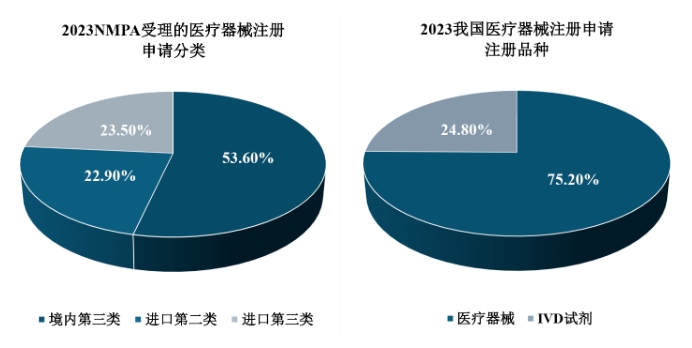
2023年,我国医疗器械的注册申请总量较2022年增加了25.4%。其中,从注册分类来看,NMPA受理境内第三类医疗器械注册申请7,106项,受理进口医疗器械注册申请6,154项(包括进口第二类医疗器械3,036项,进口第三类医疗器械3,118项)。从注册品种来看,医疗器械注册申请有9,968项,体外诊断试剂(IVD试剂)注册申请有3,292项。其中,IVD试剂2023年占全部医疗器械注册申请比例为24.80%,相较于2022年注册申请的数量与占比均有所上升。
二、注册申请审结量小幅增长
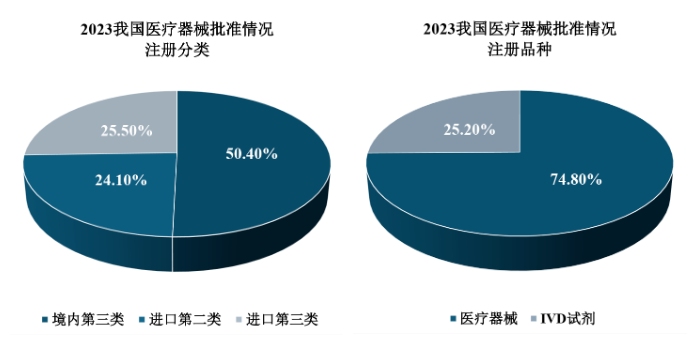
其中,从注册分类来看,批准境内第三类医疗器械注册申请6,151项,批准进口医疗器械注册申请6,062项(包括进口第二类医疗器械2,947项,进口第三类医疗器械3,115项),进口医疗器械的批准量较2022年减少了3%。
从注册品种来看,共批准医疗器械注册申请9,130项,共批准IVD试剂注册申请3,083项。其中,就IVD试剂而言,2023年相较于2022年批准的数量与占比均有小幅上升。
2023年,NMPA共批准医疗器械注册申请12,213项,与2022年相比增长2.3%,在数量有小幅增长,但增速有所放缓。
三、快速通道加快新产品、好产品上市
自审评审批制度改革以来,我国已设置了创新医疗器械特别审查程序、医疗器械优先审批程序和医疗器械应急审批程序等多个针对不同医疗器械产品的加速审评审批通道,在加快新产品、好产品上市,满足患者多方位需求上起到了重要作用。
各个加速通道的法律依据与适用范围整理如下表:
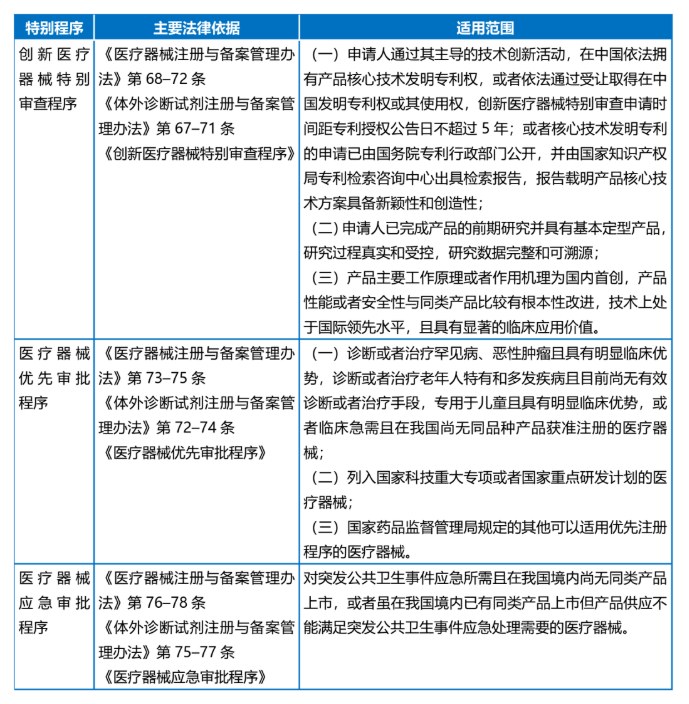
在2023年度医疗器械注册工作报告中,就医疗器械的加速审评审批通道而言,特别提到了创新医疗器械特别审查程序的适用情况,指出2023年NMPA共收到创新医疗器械特别审批申请466项,比2022年增加35.9%,其中69项获准进入创新医疗器械特别审查程序。可见,该通道对创新医疗器械的上市起到了积极的推动作用。
四、支持鼓励创新医疗器械产品的
研发与上市
自深化审评审批制度改革以来,我国一直高度重视鼓励药械领域的创新发展,制定了众多政策以支持鼓励更多具有国际领先水平的创新产品上市。得益于监管政策的支持,近年来市场上诞生了越来越多优秀的创新医疗器械产品。
2023年,我国创新医疗器械在数量与质量上取得了显著进步。上文已经提到,我国2023年共收到创新医疗器械特别审批申请466项,比2022年增加35.9%,其中69项获准进入创新医疗器械特别审查程序。报告中还提到,2023年NMPA共批准创新医疗器械61个,较2022年增长近11%。在获批的创新医疗器械中,有源手术器械、无源植入器械、医用软件、医用成像器械、放射治疗器械等高端医疗器械在数量上是批准的创新医疗器械的前五位。
在数量增加的同时,我国创新医疗器械的质量也在不断提升。2023年,我国在全球率先批准"破坏交感神经治疗肺动脉高压的一次性使用环形肺动脉射频消融导管"上市,此外还有不少创新产品技术都达到了国际领先水平,更好地满足了公众使用高端医疗器械的需求。
五、真实世界研究政策与应用
进一步发展
2023年,我国监管部门继续探索完善适用于医疗器械的真实世界证据指导原则体系。例如医疗器械技术审评中心(CMDE)于2023年9月发布《医疗器械真实世界研究设计和统计分析注册审查指导原则(征求意见稿)》以期规范和合理引导真实世界数据在医疗器械临床评价中的应用。相应指导原则在2024年1月已正式发布实施。此外,2023年也见证了更多试点产品的成功上市。根据2023年度医疗器械注册工作报告,我国在2023年批准了人工耳蜗声音处理器等3个海南临床真实世界应用试点产品上市。
于2019年启动的海南博鳌乐城国际医疗旅游先行区临床真实世界数据应用试点工作是由海南省人民政府与NMPA共同推动的一个重要项目,展现了中国在药械监管领域的创新尝试,且相关临床真实世界数据应用试点工作业已取得显著成效。截至目前,该项目已累计批准9个试点医疗器械产品上市,惠及了更多患者。
六、监管指导机制日益成熟
高质量、高效率的医疗器械审评审批活动的开展离不开专业审评力量。2023年CMDE长三角、大湾区审评分中心的审评人员数量分别增加176%、109%,大大提升了我国医疗器械技术审查能力。
此外,2023年,CMDE共计发布了67项指导原则和6项审评要点,现行有效指导原则达到613项,对医疗器械分类目录覆盖率达92.2%。大量指导原则的发布有助于不断推动研发活动与审评活动的规范化。
七、总结与展望
回顾2023年我国医疗器械审评审批情况,可以看出近年来我国深化药械审评审批制度改革已经取得了显著的成效,近年来在我国注册申请的医疗器械的数量与质量都有了大幅度的提升。随着2023年《医疗器械管理法》首次被列入人大常委会立法规划,我们相信在可预见的未来,我国的医疗器械监管规则体系一定会发展得更加完善。我们也十分期待2024年我国的医疗器械审评审批与监管工作能够创造新的成就,见证更多好产品的上市、惠及更多患者。
The content of this article is intended to provide a general guide to the subject matter. Specialist advice should be sought about your specific circumstances.
[View Source]





