- within Food, Drugs, Healthcare and Life Sciences topic(s)
- in Oceania
- within Food, Drugs, Healthcare and Life Sciences topic(s)
- in Oceania
- within Food, Drugs, Healthcare, Life Sciences, International Law and Technology topic(s)
2023年9月8日,国家科学技术部直属中国生物技术发展中心公布了《关于发布人类遗传资源管理常见问题解答的通知》(“ 《常见问题解答》”),对人类遗传资源(“ 人遗资源”)监管中涉及的常见咨询问题进行了凝练和回答,为业界更好地理解新规《人类遗传资源管理条例实施细则》(“ 《实施细则》”)和配套的行政指南、顺利开展行政审批备案与事先报告程序提供了有益的参考(本所关于《实施细则》和相应行政指南的的解读文章请参见:汉坤 • 观点 | 重磅首发:《人类遗传资源管理条例实施细则》要点解读和 汉坤 • 观点 | 解读新版人类遗传资源行政指南。
值得注意的是,《常见问题解答》反映了《实施细则》新规出台后我国人遗资源管理的最新监管口径,且明确了往期科技部所发布的《关于更新人类遗传资源管理常见问题解答的通知》和《关于更新人类遗传资源管理常见问题解答(系列问答二)的通知》(“ 《旧版问题解答》”)将予以作废。
本文将按照《常见问题解答》文件中的问答顺序,结合人遗资源监管法规和实践经验,对其中的重点问答条款进行分析和解读,供业界同仁参考和讨论。
一、采集、保藏行政许可
值得欣喜的是,不同于《旧版问题解答》要求与国际合作许可关联的人遗资源采集,若涉及规定种类或超过规定数量应单独进行采集许可申报,《常见问题解答》根据《实施细则》的要求,再次明确对于同时符合采集许可和国际科学合作科学研究行政许可/国际合作临床试验备案范围的项目,仅申报国际科学合作科学研究行政许可/国际合作临床试验备案即可。对于需要采集规定种类或超出规定数量的人遗资源的国际合作研究项目而言,是申报程序上的精简和利好。
二、国际合作行政许可与备案
(一)仅EDC供应商是外方单位情形
与《旧版问题解答》规定一致,《常见问题解答》再次明确,若临床试验中合作各方均为中方单位,而只有EDC供应商是外方单位,则不需要申请国际科学合作科学研究行政许可/国际合作临床试验备案。
(二)项目申办者和临床试验申请人的一致性
与《旧版问题解答》规定一致,《常见问题解答》再次明确,以上市为目的的临床试验申办方需要与临床试验的批件、通知书或备案公布材料的申请方保持一致。因此,非获批/已备案临床试验申请的持有人,包括其关联公司,原则上都不应被填报为国际合作临床试验备案项目的申办方。不过,《常见问题解答》同时规定了可以通过提交相关协议等证明材料,明确各自权责的方式,申报由非获批/已备案临床试验申请的持有主体担任国际合作的申办方,为新药研发注册项目中对IND和NDA申请人的灵活安排留下空间。
(三)项目中的单位性质变更
与《旧版问题解答》规定一致,《常见问题解答》再次明确,若正在进行的临床试验项目的合作方单位性质变更为外方单位,该项目必须先行暂停,待国际科学研究合作获批或国际合作临床试验备案取得备案号后方可继续开展
(四)外方单位不实质参与项目情形
与《旧版问题解答》规定一致,《常见问题解答》再次明确,若外方对于科学研究项目没有实质性的参与,不获取研究相关数据信息,不共享相应研究成果(例如外资制药企业仅为医疗机构的研究者提供临床研究用药或部分研究经费资助而不分享研究成果),则不需要申报国际科学研究合作许可/国际合作临床试验备案。
(五)备案项目变更为许可项目
与《旧版问题解答》规定逻辑一致,《常见问题解答》规定,若项目已进行国际合作临床试验备案,但因条件改变需转为国际科学研究合作许可,则应及时暂停相应研究项目,重新申请国际科学研究合作许可并在其他证明材料中上传总结说明,待获得审批许可后再开展相应研究内容。
(六)国际合作中的“其他单位”
《常见问题解答》对于国际合作中“其他单位”的范围界定,是本次新规的一大亮点。《旧版问题解答》和《常见问题解答》中对于“其他单位”的界定和变化如下

据此,我们理解《常见问题解答》明确了参与医疗卫生机构,不属于其他单位的范围;EDC供应商等可以接触到管理范围内人遗资源信息并作实质性参与的单位仍然属于其他单位的范围。
(七)申报材料中的国际合作协议
申报国际合作审批/备案中,是否需要提交签字盖章的合作协议以及需要递交协议的具体范围,始终是业界开展项目实践中非常关心的问题。《常见问题解答》明确国际合作审批/备案需要递交的国际合作协议范围如下:

值得注意的是,国际合作临床试验备案中需要递交包括其他单位在内的全部合作单位涉及的国际合作协议。据此,我们理解在相应国际合作临床试验项目备案通过后,在项目管理范围内向其他单位传输人遗信息可能不再需要履行事先报告程序。此外,除组长单位之外的其他参与医疗卫生机构的签字盖章版国际合作协议不需要在申报国际合作审批/备案中提交,是较为明确的利好。
三、信息对外提供或开放使用事先报告
(一)利用已公开的人遗资源信息
与《旧版问题解答》规定一致,《常见问题解答》再次明确,外方单位利用已公开的人遗资源信息,不需要进行信息备份和事先报告。
(二)向合作外方单位分享数据
《常见问题解答》规定,将研究产生的人遗资源信息传输给EDC供应商或数据统计公司等外方单位按照约定的数据管理范围开展工作不需要进行信息备份和事先报告程序。但如果数据分享和使用活动超出项目约定数据管理范围,仍然需要由中方数据信息所有者申请信息对外提供或履行开放使用事先报告。
四、其他问题
(一)监管的人遗资源材料和人遗资源信息范围和方式
自《实施细则》、新版行政指南到今日发布的《常见问题解答》,科技部对于人遗资源的监管范围保持着谨慎但渐进的放松趋势。如我们近日参加上海市生物医药科技发展中心举办的人遗资源监管问题座谈会所讨论人遗资源材料和信息监管范围和方式变化,《常见问题解答》进一步明确了对血清、血浆等生物样本和其检测数据的监管要求,是明显的利好。
01) 人遗资源材料方面
《常见问题解答》明确,尿液、粪便、血清、血浆等生物样本不再纳入人遗材料管理范围,其强调,尽管前述生物样本可能含有极少量脱落、残留或游离细胞或基因的生物样本,但不再纳入人遗资源材料的监管范围,这是对新版行政指南规定的人遗资源材料监管范围的进一步明确和放宽。
需要注意,仅血清、血浆等生物样本被排除在人遗资源材料监管范围内,用于制备血清、血浆的全血等材料仍然受到人遗资源材料监管。相应的,检测单位的管理定性也有区分,详见下表。
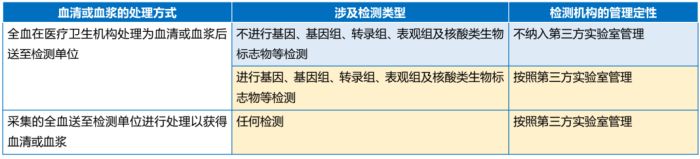
02) 人遗资源信息方面
《常见问题解答》明确,利用尿液、粪便、血清或者血浆等材料用于科学研究进行基因、基因组、转录组、表观组及核酸类生物标志物等检测产生的数据依然按照人遗信息管理,但是仅在涉及国际合作、信息对外提供或开放使用事项时适用管理要求。
我们理解,尽管《常见问题解答》中明确豁免了对血清、血浆等材料作为人遗资源材料的监管要求,鉴于血清、血浆等材料可以用以检测ctDNA等核酸类生物标志物等人遗资源数据信息。从“该管的管、该放的放”角度出发,《常见问题解答》要求对于利用血清、血浆等材料产生的人遗资源信息,在涉及国际合作、信息对外提供或开放使用事项时遵守管理要求。具体监管要求如下:
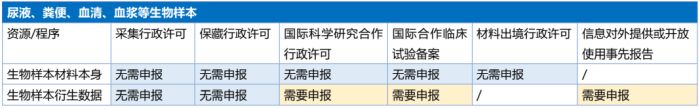
(二)申请变更过程中的受试者入组
《常见问题解答》明确,对于已获得许可利用中国人遗资源开展国际合作的项目涉及变更的,在申请变更过程中,可以按照原获批事项筛选受试者入组,如果需要以未获批的其他标准筛选受试者入组的,应等待变更的事项应在获得同意变更审批决定后方可开展。我们理解本项要求与过往规则一致,仅是澄清。
五、结尾
在《实施细则》发布后,我国人遗资源监管要求不断更新和完善。从《实施细则》对“外方单位”、“国际合作备案”等要求的放宽,到《常见问题解答》中对“采集许可”申报和“人遗资源材料”监管范围等要求的减负,整体而言,现阶段的人遗监管规则呈现出更多的弹性和灵活性,利好业界对我国人遗资源的利用。不过整体而言,我国人遗资源监管依然呈现出高要求、严监管、灵活动态调整的特点,将更加侧重事中事后监管。业界需要对人遗资源监管的要求予以高度重视和持续关注。
Originally Published 8 September 2023
The content of this article is intended to provide a general guide to the subject matter. Specialist advice should be sought about your specific circumstances.
[View Source]




